2025年成考高起点《理化综合》每日一练试题01月13日
2025-01-13 12:08:34 来源:人人学历网
2025年成考高起点《理化综合》每日一练试题01月13日,可以帮助我们积累知识点和做题经验,进而提升做题速度。通过成考高起点每日一练的积累,助力我们更容易取得最后的成功。
单选题
1、某元素的氢化物的分子式为RH4,其最高氧化物中含氧的质量分数为53%。又知该元素的原子核内质子数等于中子数。则该元素位于周期表的()。
- A:第二周期
- B:ⅡA族
- C:ⅣA族
- D:VIA族
答 案:C
解 析:(1)要想知道元素在周期表中的位置,需知道元素的原子序数,由氢化物的分子式RH4可知,其最高价氧化物的分子式为RO2。设R的原子质量数为x,则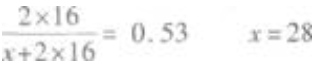 (2)因质子数等于中子数,所以该元素的质子数即原子序数为28÷2=14。其元素原子的电
(2)因质子数等于中子数,所以该元素的质子数即原子序数为28÷2=14。其元素原子的电 
2、环氧乙烷可以用于医用口罩的消毒。通过催化氧化乙烯制备环氧乙烷的反应如下: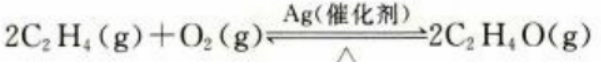 放热反应。当反应在密闭容器里达到平衡后,下列措施中可提高乙烯平衡转化率的是()。
放热反应。当反应在密闭容器里达到平衡后,下列措施中可提高乙烯平衡转化率的是()。
- A:减小压强
- B:通入O2
- C:升高温度
- D:增加Ag的用量
答 案:B
解 析:本题考查了化学平衡的影响因素的知识点。 制备环氧乙烷的反应属于分子数减少的放热反应,减小压强(增大容器的容积)、升高温度,平衡左移,乙烯的平衡转化率减小,银属于催化剂,不影响平衡移动,氧气属于另一种反应物,通入氧气,平衡右移,乙烯的平衡转化率增大,B项正确。
多选题
1、某溶液中有NH4+、Mg2+、Al3+、Fe2+等4种离子, 若向其中加入过量的 NaOH溶液, 微热并搅拌, 再加入过量的盐酸, 溶液中大量减少的阳离子是
- A:NH4+
- B:Mg2+
- C:Fe2+
- D:Al3+
答 案:AC
主观题
1、工业上用焙烧NaHCO3的方法生产纯碱(Na2CO3)。现有17.5g的NaHCO3样品,加热分解完全后,生成标准状况下的CO2气体2.24L。写出NaHCO3分解反应的化学方程式,计算此NaHCO3样品的纯度。
答 案:NaHCO3分解反应的化学方程式如下: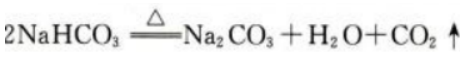 反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
2、如图,一质量为m1的木块静置在光滑的水平面上,一质量为m2的子弹以速度v0水平射入木块,进入木块s距离后相对木块静止。设子弹相对木块静止前受到的阻力恒定。求从子弹开始进入到相对木块静止这段时间内
(1)子弹与木块组成的系统损失的机械能。
(2)木块移动的距离。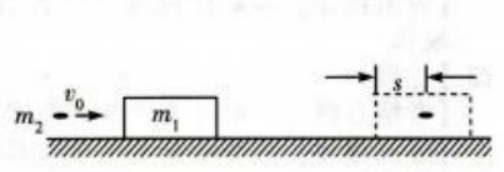
答 案:(1)根据动量守恒定律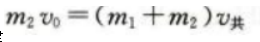 根据功能关系
根据功能关系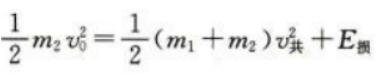
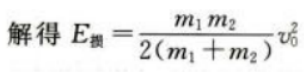 (2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
(2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
填空题
1、某人在10m高的平台上以10m/s的初速度斜向上抛出一个质量为0.5kg的物体,物体着地时的速度为15m/s,那么这个人在把物体抛出时做的功等于()J,物体在运动过程克服空气阻力做的功等于()J(g取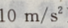 )
)
答 案:25,18.57
解 析:抛出物体时做功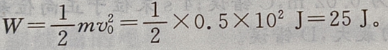 设物体在运动过程中克服空气阻力做的功为
设物体在运动过程中克服空气阻力做的功为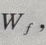 由动能定理得
由动能定理得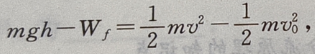 解得
解得
2、质量相等的Li、Na、K三种金属分别加入足量的水中完全反应,在相同条件下所得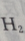 的体积比为()
的体积比为()
答 案: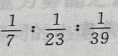
解 析:由于三者分别与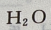 反应的化学方程式是
反应的化学方程式是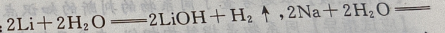
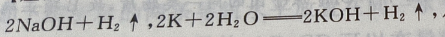 质量相等的Li、Na、K与水反应生成
质量相等的Li、Na、K与水反应生成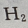 的物质的量之比为
的物质的量之比为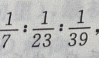 故相同条件下其体积比为
故相同条件下其体积比为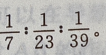
简答题
1、市售锌粉中含有氧化锌等杂质。用3g这种锌粉跟足量的盐酸完全反应,可收集到896mLH2(标准状况),计算这种锌粉中锌的质量分数。
答 案:解:设参加反应的锌的质量为m,则根据化学方程式得: 锌粉中锌的质量分数是ω=
锌粉中锌的质量分数是ω=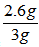 ×100%=86.7% 答:这种锌粉中锌的质量分数是86.7%。
×100%=86.7% 答:这种锌粉中锌的质量分数是86.7%。
2、一定质量的某铝屑和铁屑的混合物与足量稀硫酸反应后放出氢气8.96L(标准状况),同质量的此混合物与足量的氢氧化钠溶液反应,放出氢气6.72L(标准状况),求混合物中铝和铁的质量。
答 案: 答:原混合物中铝的质量为5.4g,铁的质量为5.6g。
答:原混合物中铝的质量为5.4g,铁的质量为5.6g。



