2025年成考高起点《理化综合》每日一练试题03月29日
2025-03-29 12:02:27 来源:人人学历网
2025年成考高起点《理化综合》每日一练试题03月29日,可以帮助我们积累知识点和做题经验,进而提升做题速度。通过成考高起点每日一练的积累,助力我们更容易取得最后的成功。
单选题
1、从粗食盐提纯氯化钠的实验过程中,没有用到的操作是()。
- A:分液
- B:过滤
- C:蒸发
- D:结晶
答 案:A
解 析:本题考查了物质提纯的知识点。 从粗盐提纯氯化钠的实验过程中,用到了蒸发、结晶、过滤操作,但用不到分液操作,只有A项符合题意。
2、下列关于Cl2的描述,正确的是()。
- A:Cl2以液态形式存在时可称作氯水或液氯
- B:红热的铜丝在氯气中燃烧后生成蓝色的CuCl2
- C:氯气既可作氧化剂又可作还原剂
- D:Fe在Cl2中燃烧生成FeCl2
答 案:C
多选题
1、某溶液中有NH4+、Mg2+、Al3+、Fe2+等4种离子, 若向其中加入过量的 NaOH溶液, 微热并搅拌, 再加入过量的盐酸, 溶液中大量减少的阳离子是
- A:NH4+
- B:Mg2+
- C:Fe2+
- D:Al3+
答 案:AC
主观题
1、工业上用焙烧NaHCO3的方法生产纯碱(Na2CO3)。现有17.5g的NaHCO3样品,加热分解完全后,生成标准状况下的CO2气体2.24L。写出NaHCO3分解反应的化学方程式,计算此NaHCO3样品的纯度。
答 案:NaHCO3分解反应的化学方程式如下: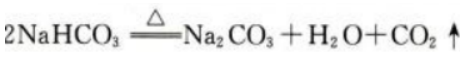 反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
2、一绝缘细绳上端固定,下端连接在一质量m=0.08kg、长度l=0.4m的均匀金属棒中心,整个装置处在一匀强磁场中,磁场的磁感应强度大小B=0.5T,方向竖直向上,如图所示。现使一电流流过金属棒,已知电流大小I=3A,方向垂直于纸面向里,重力加速度大小g取10m/s2。求
(1)金属棒所受安培力的大小和方向。
(2)平衡后细绳中张力的大小及细绳与竖直方向夹角的正切值。
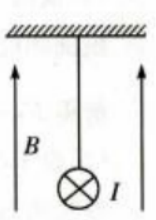
答 案:.(1)金属棒所受安培力为F=BIL=0.6N,根据左手定则知,方向水平向右。 (2)金属棒所受重力为G=mg=0.8N平衡后,安培力与重力的合力与绳中张力等大反向,设细绳与竖直方向的夹角为θ,则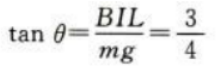 绳中张力大小为
绳中张力大小为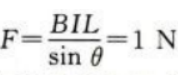
填空题
1、mg金属A与含n mol氯化氢的盐酸恰好完全反应,生成化合物ACl2和氢气,则A的原子量为()。
答 案:2m/n
解 析: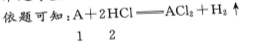
2、标准状况下,11.2L甲烷所含的电子数为()个。
答 案:3.01×1024
解 析:1个CH4分子含电子数:6+1×4=10(个),11.2升CH4的物质的量:11.2/22.4=0.5(mol),所以标准状况下11.2升CH4所含的电子数为:0.5×10×6.02×1023=3.01×1024。
简答题
1、如图1-11所示,电阻R1=R2=R3=30Ω,电源内阻忽略不计。已知当开关S断开时,电阻R3的功率P3=30W。求: (1)通过电阻R1的电流;
(2)电源电动势 的大小;
(3)当S合上时R3的电功率。
的大小;
(3)当S合上时R3的电功率。
答 案:(1)当S断开时,外电路是R2、R3并联后再与R1串联的混联电路。因为R2=R3,所以通过的电流I2=I3① R2、R3的并联电阻为 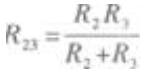 题意给出R1=R2=R3,所以
题意给出R1=R2=R3,所以  由电功率的公式
由电功率的公式  代入题给数值得
代入题给数值得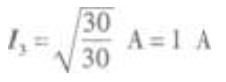 电路的总电流为 I=I1=I2+I3
电路的总电流为 I=I1=I2+I3
把式①代入得 I1=2I3=2×1A=2A.
(2)当S断开时,电路的外电阻为
R=R1+R23 因为电源内阻忽略,所以电源的电动势等于路端电压
因为电源内阻忽略,所以电源的电动势等于路端电压 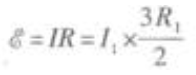 代人已知数值得
代人已知数值得 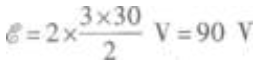 (3)当开关S闭合时,电路中的外电路是R2、R3的并联电路,所以外电阻为R23,因此电路的总电流为
(3)当开关S闭合时,电路中的外电路是R2、R3的并联电路,所以外电阻为R23,因此电路的总电流为 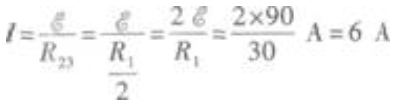 因为R2、R3并联,且R2=R3,所以消耗在R2、R3上的电功率相等,都等于电源功率的一半。因此R3的电功率为
因为R2、R3并联,且R2=R3,所以消耗在R2、R3上的电功率相等,都等于电源功率的一半。因此R3的电功率为 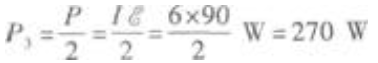 本题是有关电路计算的试题,考查的知识点是闭合电路欧姆定律、欧姆定律和电功率等。解题的关键是弄清外电路中电阻的连接方式。特别要注意的是当开关S闭合后,电阻R1被短接,不起作用,外电路是R2、R3的并联电路。
本题是有关电路计算的试题,考查的知识点是闭合电路欧姆定律、欧姆定律和电功率等。解题的关键是弄清外电路中电阻的连接方式。特别要注意的是当开关S闭合后,电阻R1被短接,不起作用,外电路是R2、R3的并联电路。
2、在相同条件下,0.1molZn和0.1molAl分别跟足量的稀盐酸反应,哪个反应放出的氢气多?
答 案:锌和铝分别跟稀盐酸反应的化学方程式是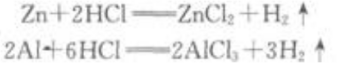 从方程式可知1molZn跟足量的稀盐酸反应,可以放出1molH2;1mol Al跟足量的稀盐酸反应,可以放出1.5 mol H2.由此可知,0.1mol AI跟足量的稀盐酸反应放出的氢气比0.1molZn放出的多.
答:0.1mol AI与足量的稀盐酸反应放出的氢气多
从方程式可知1molZn跟足量的稀盐酸反应,可以放出1molH2;1mol Al跟足量的稀盐酸反应,可以放出1.5 mol H2.由此可知,0.1mol AI跟足量的稀盐酸反应放出的氢气比0.1molZn放出的多.
答:0.1mol AI与足量的稀盐酸反应放出的氢气多



